Aturan Konfigurasi Elektron

Terdapat aturan dalam konfigurasi elektron yakni.
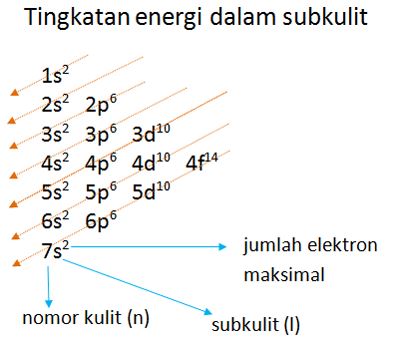
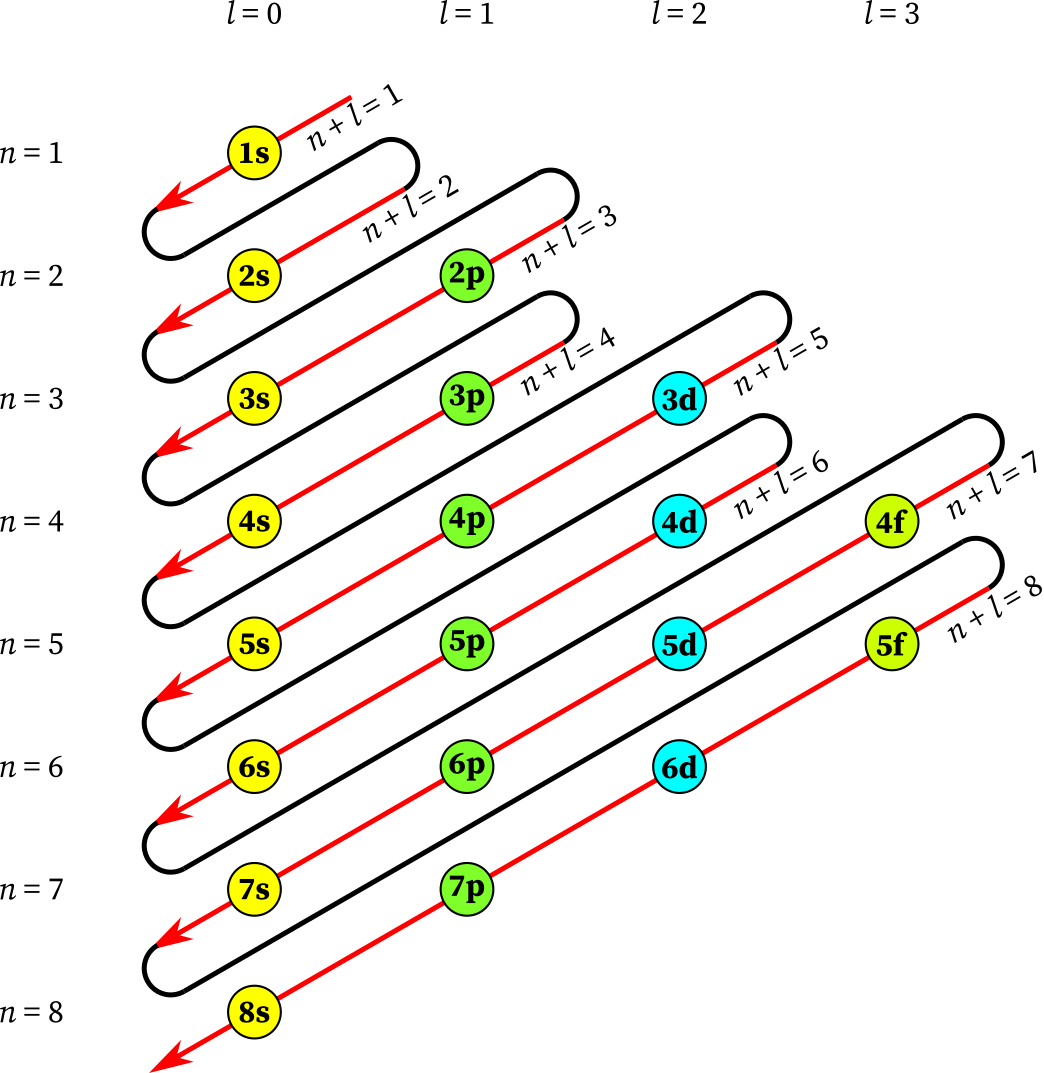
Aturan konfigurasi elektron. Berdasarkan percobaan konfigurasi 24 Cr Ar 3d 4 4s 1 sehingga diagram orbitalnya adalah. Aturan terakhir dalam konfigurasi elektron yaitu aturan penuhsetangah penuh dimana aturan ini menyatakan bahwa suatu elektron dapat berpindah ke orbital lain untuk mencapai susunan yang lebih stabil. Elektron menempati orbital-orbital dimulai dari tingkat energi yang terendah dimulai dari 1s 2s 2p dan seterusnya seperti urutan subkulit yang terlihat pada Gambar 2. Macam Macam Konfigurasi Elektron.
Aturan konfigurasi elektron tersebut yaitu. Contoh Penulisan konfigurasi stabil. Aturan penuhsetengah penuh ini diterapkan untuk konfigurasi elektron yang memiliki akhir yaitu pada sub-kulit d. Mampu membuat konfigurasi elektron dan memanfaatkannya untuk mengetahui letak unsur dalam SPU dan membandingkan sifat-sifat unsurNars-KD-3-07 1 2.
Aturan Aufbau merupakan salah satu aturan yang paling digunakan dalam suatu konfigurasi elektron. Aturan dalam konfigurasi elektron terdiri dari tiga yakni Prinsip Aufbau Aturan Hund dan Larangan Pauli. Jadi ada dua cara menyatakan konfigurasi elektron nih. Berdasarkan asas Aufbau pengisian elektron pada orbital dimulai dari subkulit yang memiliki tingkat energi lebih rendah ke tingkat energi yang lebih tinggi.
Aturan penentuan konfigurasi elektron berdasarkan orbital. Aturan ini menjelaskan tentang suatu pengisian orbital fungsi matematika yang menggambarkan perilaku elektron yang dimulai dari tingkat energi rendah ke yang tingkat energi tinggi. Setelah mengetahui mengenai bilangan kuantum kita akan membahas mengetahi konfigurasi elektron yang dalam bahasa sederhana merupakan aturan dalam pengisian elektron. Hal ini dikarenakan penentuan konfigurasi elektron atom unsur golongan transisi hanya dapat didasarkan pada orbital atom.
Sama seperti partikel elementer lainnya elektron juga harus patuh pada hukum mekanika kuantum dan menampilkan sifat sifat bak-partikel maupun bak-gelombang. Kulit pertama yang terdekat dengan inti atom disebut kulit K lalu kulit kedua disebut kulit L kulit ketiga disebut kulit M dan seterusnya berurut berdasarkan alfabet. Aturan penentuan konfigurasi elektron berdasarkan orbital. Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya.
Maksudnya setiap orbital diisi satu-satu dahulu dengan arah putaran yang sama kemudian elektron sisanya diisikan berpasangan dengan arah. Di video ini kita membahas Aturan Aufbau Aturang Hund dan Prinsip Larangan Pauli. Lintasan peredaran elektron ini disebut juga kulit elektron atau bilangan kuantum utama n. Isi Bab Ini Bilangan Kuantum Hubungan antar bilangan kuantum Orbital atom Muatan inti efektif Aturan penempatan elektron larangan Pauli Prinsip Aufbau Aturan Hund Hubungan konfigurasi elektron dengan Sistem Periodik Unsur Latihan Soal Atom Hidrogen Persamaan Schrödinger menghasilkan seperangkat fungsi keadaan yang bergantung pada tiga.
Konfigurasi Elektron Pengertian Aturan Contoh Setiap atom memiliki elektron yang menempati kulit-kulitnya menurut aturan tertentu. Untuk lebih memahaminya silahkan baca penjelasan berikut. Konfigurasi Elektron merupakan susunan elektron elektron pada sebuah atom molekul dan struktur fisik lainnya. Dalam menentukan konfigurasi elektron pada suatu orbital kalian dapat menggunakan beberapa aturan.
Bagaimana cara kita menuliskan konfigurasi elektron. Isi Bab Ini Bilangan Kuantum Hubungan antar bilangan kuantum Orbital atom Muatan inti efektif Aturan penempatan elektron larangan. Ternyata subkulit d lebih stabil pada keadaan tepat terisi penuh atau tepat setengah penuh. Aturan pengisian elektron dalam orbital atom antara lain.
Prinsip Aufbau Dilansir dari Encyclopaedia Britannica Prinsip Aufbau dikemukaan oleh fisikawan Denmark bernama Niels Bohr pada tahun 1920. Bilangan kuantum spin menggambarkan spin elektron yang dapat bernilai -12 dan 12. Kata aufbau sendiri berasal dari bahasa Jerman yang memiliki arti meningkat. Aturan Penulisan Konfigurasi Elektron.
Elektron menempati orbital-orbital dimulai dari tingkat energi yang terendah dimulai dari 1s 2s 2p dan seterusnya seperti urutan subkulit yang terlihat pada Gambar 2. Ada beberapa aturan yang digunakan untuk menuliskan konfigurasi elektron yaitu. Pengetahuan tentang konfigurasi elektron di setiap atom sangat berguna untuk memahami struktur tabel periodik. Aturan Penentuan Konfigurasi Elektron.
Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau kaidah hund larangan pauli serta hukum mekanika kuantum. Untuk video soal lebih lengkap dan pembahasan soal mendalam sekaligus support BimbelSMARRT klik link berikut httpsbitlyBimbelSmarrtOnline info. Konfigurasi Elektron juga memiliki beberapa macam. BAB III KONFIGURASI ELEKTRON Kompetensi.
Namun konfigurasi elektron berdasarkan orbital atom itu lebih berguna untuk mempelajari sifat-sifat suatu zat kimia termasuk mengapa ada zat kimia yang berwarna-warni. Bila diperhatikan konfigurasi elektron untuk unsur Sc Ti dan Cr tidak mengikuti aturan konfigurasi berdasarkan kulit elektron seperti yang telah dijelaskan di atas. Pada tahun 1927 Frederick Hund menyatakan bahwa pengisian elektron pada sub orbital dengan jumlah orbital lebih dari satu maka diisi sesuai dengan tingkat energi yang sama dengan arah putaran yang sama.