Apa Yang Dimaksud Dengan Laju Reaksi

Apa yang dimaksud dengan orde reaksi.
Apa yang dimaksud dengan laju reaksi. Rumusan H untuk asam lemah yaitu H dimana nilai Ka berbanding lurus dengan H semakin besar Ka maka H semakin besar artinya semakin kuat asamnya begitu pula sebaliknya. Ada 0025 mol H 2 SO 4 tersedia yang merupakan lebih dari 001 mol dibutuhkan. Orde keseluruhan reaksi merupakan penjumlahan orde semua komponennya. Laju reaksi yang dimaksud di sini adalah laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu.
Download Apa Yang Dimaksud Dengan Reaksi Kimia PDF 1600 MB - SamPDF. Faktor-faktor yang mempengaruhi laju reaksi dari reaksi kimia termasuk konsentrasi reaktan suhu keadaan fisik reaktan dan dispersinya pelarut dan adanya katalis. Pengertian Orde Reaksi Orde reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen itu dalam hukum laju. Karbon radioaktif memiliki kimia yang sama dengan karbon stabil dan karenanya bercampur dengan ekosfer di mana ia dikonsumsi dan menjadi bagian dari setiap organisme hidup.
Dengan menaikkan suhu maka energi kinetik molekul-molekul zat yang bereaksi akan bertambah sehingga akan lebih banyak molekul yang memiliki energi sama atau lebih besar dari EaDengan demikian lebih banyak molekul yang dapat mencapai keadaan transisi atau dengan kata lain kecepatan reaksi menjadi lebih besar. 1 Lihat jawaban ionkovalen ionkovalen Laju reaksi adalah laju berkurangnya konsentrasi reaktan zat pereaksi atau laju bertambahnya konsentrasi produk zat hasil reaksi dalam satuan waktu. Keadaan ini bersifat reversibel yaitu dapat bereaksi balik membentuk reaktan. Kesetimbangan kimia merujuk kepada keadaan ketika konsentrasi reaktan dan produk tidak berubah seiring waktu.
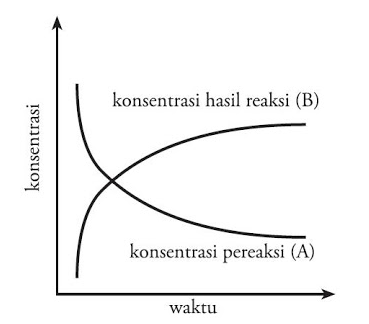
Ini dapat terjadi ketika laju reaksi maju sama dengan laju reaksi balik. Hal ini berarti ada hubungan antara konsentrasi zat yang tersisa saat itu dengan laju reaksi. Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu Besaran laju reaksi dilihat dari ukuran cepat lambatnya suatu reaksi kimia. Laju reaksi adalah kecepatan perubahan reaktan menjadi produk.
Bandingkan mol yang tersedia dari tiap reaktan ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio molJika semua 002 mol NaOH yang akan digunakan dalam reaksi itu akan membutuhkan ½ x 002 001 mol H 2 SO 4 untuk reaksi sampai selesai. Apa itu Laju peluruhan. Laju reaksi atau kecepatan reaksi menyatakan bahwa banyaknya reaksi kimia yang berlangsung per satuan waktuLaju reaksi menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap. Banyak reaksi yang terjadi di sekitar kita dengan kecepatan laju reaksi yang berbeda-beda.
Tersier -butil bromida dapat bereaksi SN1 dengan ion hidroksida. Jadi secara keseluruhan hukum laju dalam persamaan tersebut adalah orde kedua. Unsur atau senyawa yang terbentuk dari hasil tersebut dinamakan dengan produk. Lalu apa yang dimaksud dengan kesetimbangan kimia.
Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu. Jadi sudah dapat menyimpulkan apa yang dimaksud dengan konsep laju reaksi. Jika semua 0025 mol H 2 SO 4 yang akan digunakan dalam. Jadi untuk menentukan mana yang.
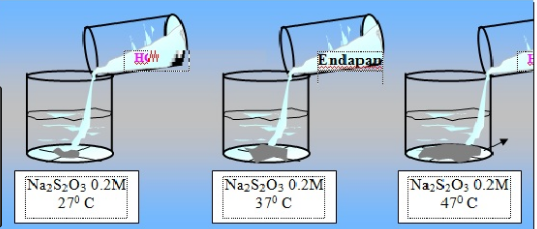
Pada tabung 1 laju reaksi. Besarnya laju reaksi dari suatu reaksi kimia dipengaruhi oleh beberapa faktor. Riski Ferdian March 09 2020 kim 11 32 Apa yang dimaksud persamaan laju reaksi. Kita dapat mengatur besarnya laju reaksi dengan cara mengubah faktor-faktor yang memengaruhi laju reaksi.
Pengertian Laju Reaksi Laju reaksi dapat didefinisikan sebagai perubahan konsentrasi pereaksi atau produk persatuan waktu. Laju reaksi mempunyai satuan Ms Molar per detik. Konsep dasar dalam mempelajari laju reaksi yang akan di pelajari di kelas 11 semester 1. Analisis laju reaksi sangatlah penting dan memiliki banyak kegunaan misalnya dalam teknik kimia dan kajian kesetimbangan kimia.
Disamping itu diperoleh kesimpulan bahwa pada reaksi SN1 pengaruh konsentrasi nukleofil terhadap laju reaksi keseluruhan sangat kecil. Dalam laju reaksi digunakan jenis konsentrasi molaritas M dimana. Penetuan laju reaksi pada umumnya dilakukan pada laju awal reaksi pada konsentrasi awal. Apa yang dimaksud persamaan laju reaksi.
Pada percobaan pertama dilakukan pengamatan pengaruh konsentrasi terhadap laju reaksi yaitu dilakukan dengan cara mereaksikan pita magnesium Mg dengan HCl yang konsentrasinya berbeda-beda. Namun perlu diingat bahwa untuk data sebuah percobaan dengan variasi beberapa faktor tidak semua faktor selalu berpengaruh. Persamaan Laju Reaksi dan Orde Reaksi laju reaksi menujukkan bahwa laju reaksi akan menurun dengan bertambahnya waktu. Pengantar laju reaksi Meskipun persamaan kimia yang seimbang untuk suatu reaksi menggambarkan hubungan kuantitatif antara jumlah reaktan yang ada dan jumlah produk yang dapat dibentuk itu tidak memberi kita informasi tentang.
Oleh gurupendidikan Diposting pada 29 November 2020. Reaktan dapat diartikan sebagai unsur atau senyawa awal yang mengalami reaksi. Laju reaksi suatu reaksi kimia merupakan pengukuran bagaimana konsentrasi ataupun tekanan zat-zat yang terlibat dalam reaksi berubah seiring dengan berjalannya waktu. Satuan laju reaksi adalah Ms atau molLs.
Faktor Yang Mempengaruhi Laju Reaksi. Artinya terjadi pengurangan konsentrasi pereaksi atau pertambahan konsentrasi produk tiap. Dengan faham dan mengerti materi ini maka akan mudah mempelajari materi sesudahnya dalam laju reaksi yaitu faktor - faktor yang memengaruhi laju reaksi. Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi.
Karbon-14 memiliki waktu paruh 5730 tahun dan diproduksi dalam reaksi nuklir yang diinduksi ketika neutrino matahari menyerang 14N di atmosfer. Pada percobaan yang dilakukan oleh penulis penulis mereaksikan kulit telur dengan berbagai larutan larutan yang bersifat asam seperti larutan asam jawa larutan jeruk larutan HCl larutan H 2 SO 4 dan larutan asam cukaKarena reaksi yang terjadi pada kulit telur terhadap masing masing larutan berbeda maka penulis pun mengkaji hal tersebut dalam karya tulis ini agar dapat. Pada tabung 1 terdapat hcl 05M pada tabung 2 terdapat HCl 1M pada tabung 3 terdapat HCl 2M dan pada tabung 4 terdapat HCl 3M.